Erscheinungsbild
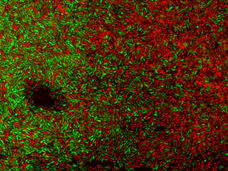
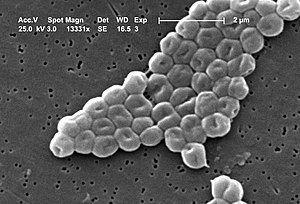
Bakterien der Art Acinetobacter baumannii sind stäbchenförmig und kommen in der stationären Phase auch kokkenförmig vor. Sie sind nicht in der Lage sich eigenständig fortzubewegen, da ihnen jegliche Ausstattung zur Motilität fehlt. A. baumannii gehört zu den gramnegativen Bakterien, ist in der Gram-Färbung jedoch häufig uneindeutig (gramvariabel) und zeigt im lichtmikroskopischen Bild kokkoide Stäbchen. Es werden keine Überdauerungsformen wie Endosporen gebildet. Auf Casein-Soja-Pepton-Agar wachsen die Bakterienkolonien kreisrund, konvex, glatt und leicht opak. Sie haben einen Durchmesser von 1,5 bis 2,0 mm nach 24 Stunden Inkubation und 3,0 bis 4,0 mm nach 48 Stunden Bebrütung bei 30 °C.
Wachstum und Stoffwechsel
Acinetobacter-Arten sind im Oxidase-Test negativ, das unterscheidet sie von Pseudomonas aus der gleichen Ordnung Pseudomonadales. Sie zählen zu den nicht-fermentierenden Bakterien (sogenannte Nonfermenter).
Das Wachstum erfolgt zwischen 15 und 44 °C. Die meisten Stämme können aus Glucose Säure bilden. Auf Blutagar erfolgt keine Hämolyse, Gelatine kann nicht hydrolysiert werden. Auf Simmons Citrat-Agar können prototrophe Stämme Citrat verwerten, auxotrophe nicht, es sei denn, sie werden zusätzlich mit Wachstumsfaktoren im Nährmedium versorgt. Weitere Stoffwechseleigenschaften sind im Abschnitt Nachweise aufgeführt.
Genetik
Das Genom des Stammes Acinetobacter baumannii AF-401 wurde im Jahr 2017 vollständig sequenziert. Es handelt sich um ein Projekt zur Genom-Sequenzierung Carbapenem-resister A. baumannii Stämme. Mittlerweile ist das Genom von mehr als 20 Stämmen erforscht. Das Genom weist eine Größe von 3982 Kilobasenpaaren (kb) auf, es sind 3953 Proteine annotiert. Die Ergebnisse der Sequenzierungen zeigen einen GC-Gehalt (den Anteil der Nukleinbasen Guanin und Cytosin) in der Bakterien-DNA von 39 Molprozent (Median). Dies liegt etwas unterhalb des in der Erstbeschreibung angegebenen GC-Gehaltes von 40–43 Molprozent. Zusätzlich zum Bakterienchromosom liegt ein Plasmid vor, auf dem sich mehrere Antibiotika-Resistenzgene befinden. Das Plasmid und damit auch die Antibiotikaresistenz kann mittels horizontalen Gentransfer zwischen Bakterienarten ausgetauscht werden.