Wissenschaftler verwenden blaugrüne Algen als Ersatzmutter für "fleischähnliche" Proteine
Anzeigen
Wir alle wissen, dass wir weniger Fleisch und Käse essen und mehr pflanzliche Lebensmittel zu uns nehmen sollten. Aber wenn wir in der Kühltheke des Supermarkts zwischen tierischen Lebensmitteln und klimafreundlicheren Eiweißalternativen wählen müssen, siegt nicht immer die Vernunft. Und auch wenn viele pflanzliche Produkte geschmacklich überzeugen, fehlt es oft an der richtigen" Textur und dem richtigen Mundgefühl.
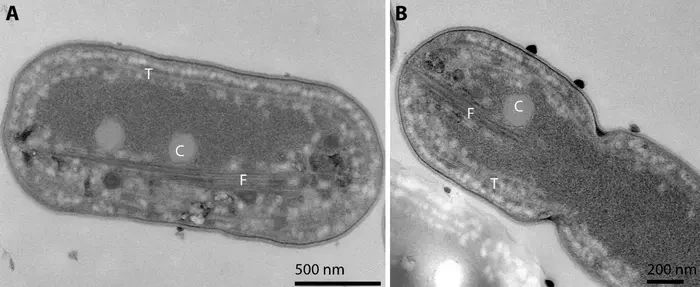
Cyanobakterien mit Proteinfasern, gesehen durch ein Mikroskop. Die Proteinfasern sind mit "F" gekennzeichnet.
From Figure 2 in the scientific article: https://pubs.acs.org/doi/10.1021/acsnano.3c08600
Außerdem sind einige pflanzliche Eiweißalternativen aufgrund der bei ihrer Verarbeitung verbrauchten Ressourcen ohnehin nicht so nachhaltig.
Aber was wäre, wenn es möglich wäre, nachhaltige, proteinreiche Lebensmittel herzustellen, die auch die richtige Textur haben? Neue Forschungsergebnisse der Universität Kopenhagen geben dieser Vision neue Nahrung. Der Schlüssel dazu? Blaugrüne Algen. Dabei handelt es sich nicht um die berüchtigte Sorte, die im Sommer als giftige Brühe im Meer schwimmt, sondern um ungiftige Algen.
"Cyanobakterien, auch bekannt als Blaualgen, sind lebende Organismen, die wir dazu bringen konnten, ein Protein zu produzieren, das sie von Natur aus nicht produzieren. Besonders spannend ist dabei, dass das Protein in faserigen Strängen gebildet wird, die ein wenig an Fleischfasern erinnern. Und es könnte möglich sein, diese Fasern in pflanzlichem Fleisch, Käse oder einer anderen neuen Art von Lebensmitteln zu verwenden, für die wir eine bestimmte Textur suchen", sagt Professor Poul Erik Jensen vom Fachbereich Lebensmittelwissenschaften.
In einer neuen Studie haben Jensen und seine Forscherkollegen, unter anderem von der Universität Kopenhagen, gezeigt, dass Cyanobakterien als Wirtsorganismen für das neue Protein dienen können, indem sie fremde Gene in ein Cyanobakterium einfügen. Innerhalb des Cyanobakteriums organisiert sich das Protein als winzige Fäden oder Nanofasern.
Minimale Verarbeitung - maximale Nachhaltigkeit
Wissenschaftler in aller Welt haben Cyanobakterien und andere Mikroalgen als potenzielle alternative Nahrungsmittel ins Visier genommen. Zum einen, weil sie wie Pflanzen durch Photosynthese wachsen, zum anderen, weil sie selbst sowohl eine große Menge an Eiweiß als auch gesunde mehrfach ungesättigte Fettsäuren enthalten.
"Ich bin ein bescheidener Typ vom Lande, der selten die Arme in die Luft wirft, aber dass man einen lebenden Organismus so manipulieren kann, dass er eine neue Art von Protein produziert, das sich selbst in Fäden organisiert, ist selten in diesem Ausmaß zu sehen - und sehr vielversprechend. Auch, weil es sich um einen Organismus handelt, der leicht nachhaltig gezüchtet werden kann, da er von Wasser, atmosphärischem CO2 und Sonnenstrahlen lebt. Dieses Ergebnis verleiht den Cyanobakterien ein noch größeres Potenzial als nachhaltige Zutat", freut sich Poul Erik Jensen, der eine Forschungsgruppe leitet, die sich auf pflanzliche Lebensmittel und Pflanzenbiochemie spezialisiert hat.
Viele Forscher auf der ganzen Welt arbeiten daran, proteinreiche Texturverbesserer für pflanzliche Lebensmittel zu entwickeln - z. B. in Form von Erbsen und Sojabohnen. Diese erfordern jedoch einen erheblichen Verarbeitungsaufwand, da die Samen gemahlen und das Protein daraus extrahiert werden muss, um eine ausreichend hohe Proteinkonzentration zu erreichen.
"Wenn wir das gesamte Cyanobakterium in Lebensmitteln verwerten können und nicht nur die Proteinfasern, wird sich der Verarbeitungsaufwand minimieren. In der Lebensmittelforschung versuchen wir, zu viel Verarbeitung zu vermeiden, da sie den Nährwert einer Zutat beeinträchtigt und außerdem sehr viel Energie verbraucht", sagt Jensen.
Das Vieh von morgen
Der Professor betont, dass es noch eine ganze Weile dauern wird, bis die Produktion von Proteinsträngen aus Cyanobakterien beginnt. Zunächst müssen die Forscher herausfinden, wie sie die Produktion von Proteinfasern durch die Cyanobakterien optimieren können. Doch Jensen ist optimistisch:
"Wir müssen diese Organismen so verfeinern, dass sie mehr Proteinfasern produzieren, und dabei die Cyanobakterien 'entführen', damit sie für uns arbeiten. Das ist ein bisschen wie bei den Milchkühen, die wir entführt haben, damit sie eine wahnsinnige Menge Milch für uns produzieren. Nur dass wir hier jegliche ethischen Überlegungen zum Tierschutz vermeiden. Wir werden unser Ziel nicht morgen erreichen, denn es gibt einige metabolische Herausforderungen im Organismus, mit denen wir lernen müssen umzugehen. Aber wir sind bereits dabei, und ich bin sicher, dass wir es schaffen können", sagt Poul Erik Jensen und fügt hinzu:
"Wenn ja, ist dies der ultimative Weg, um Proteine herzustellen.
Cyanobakterien wie Spirulina werden bereits in mehreren Ländern industriell angebaut - meist für gesunde Lebensmittel. Die Produktion erfolgt in der Regel in so genannten Rennbahnteichen unter freiem Himmel oder in Photobioreaktoren, in denen die Organismen in Glasröhren wachsen.
Laut Jensen bietet sich Dänemark als Standort für die Errichtung von "Mikroalgenfabriken" zur Herstellung verarbeiteter Cyanobakterien an. Das Land verfügt über Biotech-Unternehmen mit den richtigen Fähigkeiten und einen effizienten Agrarsektor.
"Die dänische Landwirtschaft könnte im Prinzip Cyanobakterien und andere Mikroalgen produzieren, so wie sie heute Milchprodukte herstellt. Es wäre möglich, täglich einen Teil der Zellen als frische Biomasse zu ernten oder zu melken. Wenn man die Zellen der Cyanobakterien konzentriert, erhält man etwas, das wie ein Pesto aussieht, aber Proteinstränge enthält. Und mit minimaler Verarbeitung könnte es direkt in ein Lebensmittel eingearbeitet werden.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.